
公司主营业务涉及药品研发、生产和销售,主要产品涵盖抗肿瘤药、手术麻醉类用药、特殊输液、造影剂、心血管药等众多领域。根据营业执照,公司主营业务是片剂(含抗肿瘤药)、口服溶液剂、混悬剂、无菌原料药(抗肿瘤药)、原料药(含抗肿瘤药)、精神药品、软胶囊剂(含抗肿瘤药)、冻干粉针剂(含抗肿瘤药)、粉针剂(抗肿瘤药、头孢菌素类)、吸入粉雾剂、口服混悬剂、口服乳剂、大容量注射剂(含多层共挤输液袋、含抗肿瘤药)、小容量注射剂(含抗肿瘤药、含非最终灭菌),生物工程制品(聚乙二醇重组人粒细胞刺激因子注射液)、硬胶囊剂(含抗肿瘤药)、颗粒剂(抗肿瘤药)、粉雾剂、膜剂、凝胶剂、乳膏剂的制造;中药前处理及提取;医疗器械的研发、制造与销售;一般化工产品的销售;自营和代理各类商品及技术的进出口业务。
公司通过科学管理制度的构建和先进技术的运用确保采购质量与效率。在制度上,完善供应商筛选以及跟踪制度,重点把控大宗物料招标,规范化工原料招标采购,强化对子公司物料招标采购的管理,根据实际情况调整招标机构并推行人员轮岗;在技术上,构建集团采购平台,通过生产系统增加合格供应商等方式,加大招标力度,最大程度降低采购成本。
在生产方面,公司本着“诚实守信,质量第一”的原则,集中发挥人才、设备、资金等优势,始终保持质量上的高标准,公司所有的生产线均已通过新版GMP认证。为努力成为国内质量标准的领跑者、国际质量标准的竞争者,公司自2005年开始就把生产体系目标瞄准了国际知名企业,
建立了拥有一流生产设备、国际标准化的生产车间。在管理方面,公司根据美国FDA对产品全生命周期的管理要求,聘请国际一流的质量控制专家,建立了以质量体系为中心的GMP六大管理体系,将GMP贯彻到原料采购、药品生产、控制及产品放行、贮存发运的全过程中,确保所生产的药品符合预定用途、注册要求和客户要求。
公司秉持“以市场为导向,以客户为中心,合理配置资源”,围绕“专注始于分线,专业成就未来”的销售理念,2018年开始,建立产品线事业部制,在公司层面成立肿瘤事业部、影像事业部、综合产品、手术麻醉事业部,不断创新思路,完善人员组织构架,推进分线销售改革,转变营销模式,逐步建立“四纵一横”的专业化营销体系。目前,公司已经构建了遍及全国的销售网络,形成了专业、规范、有序、完善的销售体系;同时,公司立足于打造系统化、专业化的培训体系,不断提升各部门人员的专业化水平,为做深做透市场、做大做强产品的销售目标夯实基础。
2019年医药制造业规模以上工业企业实现营业收入23908.6亿元,同比增长7.4%,高于全国规模以上工业企业同期整体水平3.6个百分点。发生营业成本13505.4亿元,同比增长5.7%,高于全国规模以上工业企业同期整体水平1.6个百分点。实现利润总额3119.5亿元,同比增长5.9%,高于全国规模以上工业企业同期整体水平9.2个百分点。医药制造营业收入利润率约为13.05%,较上年同期提升0.3个百分点,高于全国规模以上工业企业同期整体水平7.19个百分点。(数据来源:国家统计局)
医药行业是国家战略性新兴产业,关系国计民生,是国民经济的重要组成部分。根据IQVIA数据统计,2019年全球药品支出接近1.3万亿美元,中国为全球第二大医药市场,预计到2023年全球药品支出将超1.5万亿美元。我国医药行业正经历高速增长期,随着我国人口老龄化加剧,城镇化水平不断提高,医疗保障制度逐渐完善,国民药品消费刚需将持续扩大,我国医药行业整体将呈现出持续向好的发展趋势。
当前,以仿制药为主的化学药品制剂仍占据我国药品市场容量的主导地位。未来在鼓励创新的政策趋势下,随着医药行业研发投入的逐步加大,自主研发药品数量将不断提升,尤其生物医药发展前景广阔。目前生物技术药物主要用于癌症、心血管疾病、糖尿病、传染性疾病、自身免疫性疾病等疾病的治疗,全球生物药市场已超2000亿美元,并仍将保持高速增长。
近年来,国内药品审评审批加速以及优先审评政策出台对医药产业影响较大。无论进口品种还是国产品种,都呈现出批文数量快速上升的趋势。另一方面,随着药品审批标准提高,仿制药一致性评价持续推进,带量采购逐步扩面,行业进入快速分化、结构升级、淘汰落后产能的阶段,具有医药自主创新能力以及拥有知识产权保护的企业将在未来市场竞争中处于优势地位。
恒瑞医药是国内知名的抗肿瘤药、手术用药和造影剂的研究和生产基地之一。公司产品涵盖了抗肿瘤药、手术麻醉类用药、特色输液、造影剂、心血管药等众多领域,已形成比较完善的产品布局,其中抗肿瘤、手术麻醉、造影剂等领域市场份额在行业内名列前茅。报告期内,公司作为国内医药创新和高质量发展的代表企业,荣获“全国五一劳动奖状”,并在中国化学制药行业年度峰会中荣获“2019中国化学制药行业工业企业综合实力百强”、“2019中国化学制药行业创新型优秀企业品牌”等众多荣誉。
公司2019年各项经济指标较快增长,主要驱动因素为以下方面:一是创新成果的收获。创新成果的逐步收获对公司业绩增长起到了拉动作用。二是公司产品结构优化。随着公司产品结构调整,以手术麻醉、造影剂为代表的公司非抗肿瘤药产品在各自治疗领域内逐步扩大市场,继续保持快速增长态势。未来,公司将继续稳步推进研发创新和制剂产品的国际化,同时,也将着力于产品结构的优化提升,确保公司业绩可持续增长。
1、技术优势。经过多年的发展,公司打造了一支拥有3400多人的研发团队,先后在连云港、上海、成都和美国设立了研发中心和临床医学部,建立了国家级企业技术中心和博士后科研工作站、国家分子靶向药物工程研究中心、国家“重大新药创制”专项孵化器基地,坚持每年投入销售额10%以上的研发资金。几年来,公司先后承担了44项“国家重大新药创制”专项项目、23项国家级重点新产品项目及数十项省级科技项目,先后申请了874项发明专利,其中335项国际专利申请。创新药艾瑞昔布、阿帕替尼、硫培非格司亭、吡咯替尼、卡瑞利珠单抗和甲苯磺酸瑞马唑仑已获批上市。在创新药开发上,已基本形成了每年都有创新药申请临床,每1-2年都有创新药上市的良性发展态势。公司技术创新能力在国内位列前茅,研发团队实力明显。
2、市场优势。经过多年发展,公司建立了一支高素质、专业化的营销队伍,并在原有市场经验的基础上不断创新思路,推进复合销售模式,加强学术营销力度,建立和完善分专业的销售团队,加强了市场销售的广度和深度。
3、品牌优势。公司本着“诚实守信,质量第一”的经营原则,致力于在抗肿瘤药、手术麻醉用药、特色输液、造影剂、心血管药等领域的创新发展,并逐步形成品牌优势和较高的知名度,其中抗肿瘤药、手术麻醉用药和造影剂销售名列行业前茅。
4、质量优势。公司在质量标准严格遵从国家法定标准的基础上,还对部分关键质量指标进行严控和提高,制定了高于法定标准的企业内控标准;出口产品的控制要求均符合或高于欧盟、美国药典规定标准;公司强调系统保障和过程控制,降低非生产期间可能产生的风险;计算机系统具有审计跟踪功能,同时保证记录完整、可追溯,且数据不可删除;同时,在生产环境控制、质量要素管理等方面也有更严格更高的要求,保障药品的有效性、安全性。目前公司全部制剂均已通过了国家新版GMP认证,另有包括注射剂、口服制剂和吸入性麻醉剂在内的19个制剂产品在欧美日获批,2个制剂产品在美国获得临时性批准。
2019年是国家加速深化医疗卫生体制改革的重要一年。公司实现营业收入232.89亿元,比去年同期增长了33.70%;归属于母公司所有者的净利润53.28亿元,比去年同期增长了31.05%。
公司科技创新取得重大成果,创新药注射用卡瑞利珠单抗、注射用甲苯磺酸瑞马唑仑获批上市。报告期内,卡瑞利珠单抗肝癌二线、非小细胞肺癌一线、食管癌二线,以及氟唑帕利BRCA突变卵巢癌适应症均申请上市并获优先审评资格。创新药马来酸吡咯替尼片和硫培非格司亭注射液通过谈判首次纳入国家医保目录,阿帕替尼续谈成功,这将大大减轻患者负担,进一步提高创新药可及性。
在销售方面,公司坚持“以市场为导向,以客户为中心,合理配置资源”的原则,围绕“专注始于分线,专业成就未来”的销售理念,根据产品领域及业务职能,逐步建立和完善了事业部制的销售管理体系,形成了肿瘤、影像、麻醉、综合产品事业部,以及负责市场准入、公共事务平台、国际交流、产学研合作的战略发展事业部,完成了“四纵一横”事业部制布局,更加注重专业化、学术推广,为患者提供更专业、更精准的服务。同时,公司加强医学事务系统建设、市场学术队伍建设,注重战略合作和资源整合,加快新旧动能转换、创新药推广,加速OTC市场、第三终端、县域市场布局。
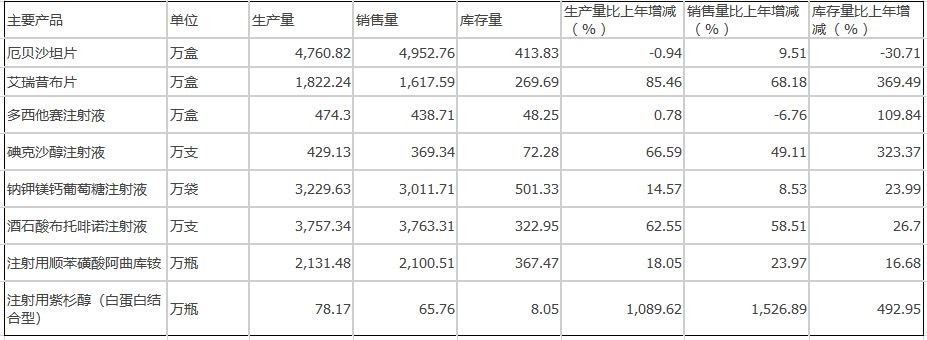
在研发创新方面,一是继续加大研发投入。累计研发投入38.96亿元,比上年增长45.90%,研发投入占销售收入的比重达到16.73%,有力地支持了公司的项目研发和创新发展。二是完善研发质量系统,加强合规管理,推进跨部门项目协调,确保研究工作有序、有效、合规进行。三是专利申请和维持工作顺利开展。本年度提交国内新申请专利131件,提交国际PCT新申请63件,获得国内授权38件,获得国外授权53件。四是项目注册申报有序推进。本年度取得创新药制剂生产批件2个,仿制药制剂生产批件11个;取得创新药临床批件29个,仿制药临床批件2个。取得2个品种的一致性评价批件,完成8种产品的一致性评价申报工作。
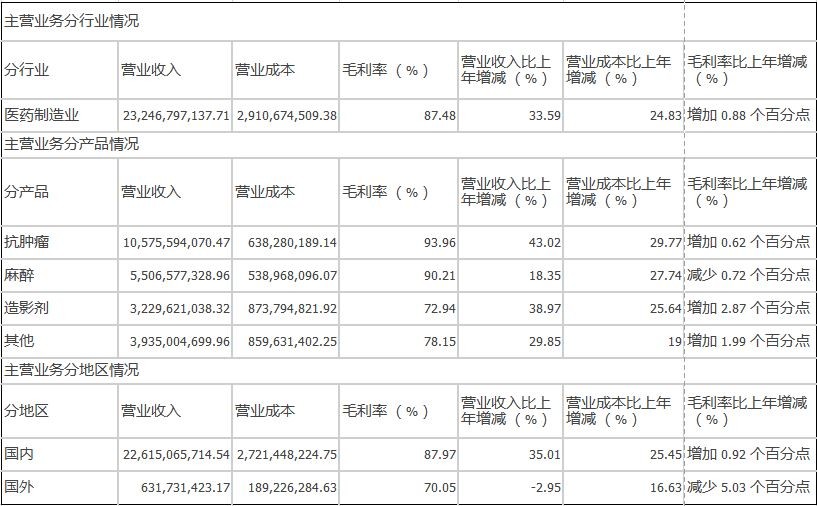
公司逐步建立和完善事业部制的销售管理体系,形成了肿瘤、影像、手术麻醉、综合产品事业部,以及战略发展事业部,更加注重专业化、学术推广,创新药产品稳步增长,报告期肿瘤药品销售收入较去年增长43.02%,影像产品销售收入较去年增长38.97%。
前五名客户销售额255,312.07万元,占年度销售总额10.98%;其中前五名客户销售额中关联方销售额0万元,占年度销售总额0%。
前五名供应商采购额104,941.72万元,占年度采购总额33.91%;其中前五名供应商采购额中关联方采购额0万元,占年度采购总额0%。
费用
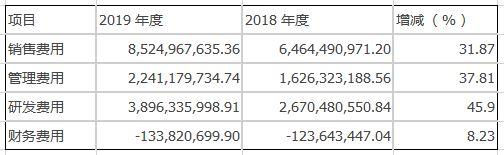
现金流
行业政策情况
国家《药品管理法》完成修订,2019年12月1日起施行。
一是鼓励研发创新,保障供应可及。支持以临床价值为导向、对人的疾病具有明确或者特殊疗效的药物创新,鼓励具有新的治疗机理、治疗严重危及生命的疾病或者罕见病、对人体具有多靶向系统性调节干预功能等的新药研制,鼓励儿童用药品的研制和创新,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评。同时,明确实行药品储备制度、建立药品供求监测体系、实行短缺药品清单管理、短缺药品优先审评制度,加强药品供应保障。
二是落实行政审批制度改革要求,提高审批效率。将临床试验审批制改为到期默示许可制,生物等效性试验和临床试验机构改为备案制,取消药品生产质量管理规范认证、药品经营质量管理规范认证制度,将原辅料改为与药品一并审批。
三是加强药品全过程监管,提高违法处罚力度。明确药品安全工作要遵循“风险管理、全程管控、社会共治”的基本原则,全面实施药品上市许可持有人制度,从药物警戒、监督检查、信用管理、应急处置等方面强化了药品全生命周期管理理念的落实。加大对违法行为的处罚力度,对严重违法的企业落实处罚到人。
《药品管理法》的修订从制度上明确鼓励研发及创新的方向,保障药品审评审批效率。公司将坚持科技创新的发展战略,以解决患者的临床需求为出发点,研发更新、更好、更多的产品。同时,将严格落实药品研发、生产及销售的全程质量管控,切实保障患者用药安全。
2019年3月25日,为规范仿制药审评和一致性评价工作,优化工作程序,国家药监局发布《化学仿制药参比制剂遴选与确定程序》,年内先后发布三批仿制药参比制剂目录。2019年9月30日,国家药监局发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》,要求申请人全面了解已上市注射剂的国内外上市背景、安全性和有效性数据、上市后不良反应监测情况,评价和确认其临床价值。
2019年仿制药一致性评价工作稳步推进,注射剂一致性评价工作有望提速,短期内将对企业研发工艺及成本控制带来挑战,但长期来看,有利于提高国内仿制药质量水平,实现优胜劣汰,提高行业集中度。报告期内公司取得2个产品的一致性评价批件,完成8个产品的一致性评价申报工作。目前固体制剂重点品种均完成了一致性评价并获批上市,下一步公司将积极推进注射剂一致性评价工作。
2019年1月17日,国务院办公厅印发《国家组织药品集中采购和使用试点方案》,为深化医药卫生体制改革,完善药品价格形成机制,选择北京、天津、上海等11个城市开展国家组织药品集中采购和使用试点,从通过质量和疗效一致性评价的仿制药对应的通用名药品中遴选试点品种,实行带量采购、以量换价。
2019年9月30日,国家医保局发布《关于国家组织药品集中采购和使用试点扩大区域范围实施意见》,扩大国家组织药品集中采购和使用试点区域范围,组织药品集中采购和使用试点中选的25个通用名药品,组织试点城市之外相关地区以省为单位形成联盟,委托联合采购办公室,开展跨区域联盟集中带量采购。
2019年11月,国务院深化医药卫生体制改革领导小组先后印发《国务院深化医药卫生体制改革领导小组关于进一步推广福建省和三明市深化医药卫生体制改革经验的通知》和《关于以药品集中采购和使用为突破口进一步深化医药卫生体制改革若干政策措施的通知》,要求2019年12月底前,各省份要全面执行国家组织药品集中采购和使用改革试点25种药品的采购和使用政策。2020年,按照国家统一部署,扩大国家组织集中采购和使用药品品种范围,优先将原研药价格高于世界主要国家和周边地区、原研药与仿制药价差大等品种,以及通过仿制药质量和疗效一致性评价的基本药物等纳入集中采购范围。
根据国家医保局公告,截至2019年4月1日,11个试点城市已经全面启动第一批带量采购,整体落地执行顺利。2020年1月17日,国家组织开展33个药品品种的第二批带量采购工作,公司产品醋酸阿比特龙片、盐酸曲美他嗪缓释片、替吉奥胶囊、注射用紫杉醇(白蛋白结合型)中标。仿制药一致性评价品种带量采购是长期趋势,能够实现药价明显降低,减轻患者药费负担,降低企业交易成本,中长期来看有利于医保基金为创新药腾出空间,公司将积极参与国家药品带量采购工作。
2019年4月17日,国家医保局发布《2019年国家医保药品目录调整工作方案》,旨在进一步提高参保人员用药保障水平,规范医保用药管理。目录调整优先考虑国家基本药物、癌症及罕见病等重大疾病治疗用药、慢性病用药、儿童用药、急救抢救用药等。
2019年8月20日,国家医疗保障局、人力资源社会保障部发布《关于印发国家基本医疗保险、工伤保险和生育保险药品目录的通知》。本次发布的常规准入部分共2643个药品,调出被国家药监部门撤销文号、临床价值不高、滥用明显、有更好替代的150个药品,确定了128个临床价值较高但价格相对较贵的独家产品作为拟谈判药品。同时,明确原则上按照通过一致性评价的仿制药价格水平对原研药和通过一致性评价仿制药制定统一的支付标准。
2019年11月28日,国家医保局、人力资源社会保障部发布《关于将2019年谈判药品纳入<国家基本医疗保险、工伤保险和生育保险药品目录>乙类范围的通知》,公布了谈判药品准入结果,目录新增药品70个,价格平均下降60.7%;续约成功药品27个,价格平均下降26.4%。要求与常规准入药品于2020年1月1日起同步实施,执行全国统一的支付标准。
医保目录调整是党和政府不断提高群众医疗保障待遇的重要举措,国家医保药品目录实现了药品“有进有出”,基金支出“腾笼换鸟”。目录内药品结构进一步优化,管理更加严格规范,用药保障质量和水平进一步提高,有利于减轻广大参保人员药品费用负担,有利于提升医保资金的使用效益,也有利于促进我国医药产业创新发展。报告期内,公司创新药马来酸吡咯替尼片和硫培非格司亭注射液被纳入国家医保目录,甲磺酸阿帕替尼片续约成功,将大大减轻患者负担,进一步提高创新药可及性。
创新是恒瑞多年来始终坚持的重大战略,也是推动公司发展的动力源泉。公司目前以抗肿瘤药、手术麻醉用药、造影剂、重大疾病以及尚未有有效治疗药物的领域为重点科研方向,形成了丰富的产品研发管线。公司打造了一支拥有3400多人的研发团队,并在美国、日本和中国多地建有研发中心,坚持每年投入销售额10%以上的研发资金。恒瑞的创新模式从创新初期“me-too”、“me-better”逐步走向源头创新,创新药布局正在从小分子药物向大分子药物转变,产生了具有自主知识产权的抗体毒素融合物(ADC)技术平台,掌握了肿瘤免疫抗体系列产品开发专有技术,在代表着全球医药产业发展方向的生物技术领域,公司搭建了一系列研发平台,并率先在国内申请国际领先的抗体毒素偶联物ADC药物(生物导弹)。截至目前,公司创新药艾瑞昔布、阿帕替尼、硫培非格司亭、吡咯替尼、卡瑞利珠单抗和甲苯磺酸瑞马唑仑上市。2019年,阿帕替尼与PD-1联合用药、SHR3680、SHR0302、SHR1459等产品获准在海外开展国际多中心临床试验。
累计研发投入38.96亿元,比上年同期增长45.90%,有力地支持了公司的项目研发和创新发展。
伴随全球人口持续增长、新兴市场的发展及人民生活水平提高、社会老龄化程度加深等因素,全球医药市场保持了稳定增长,新的医疗技术、产品层出不穷。根据IQVIA数据,近年来全球药品支出规模日益扩大,预计2023年全球药品支出将超1.5万亿美元,中国作为全球第二大医药市场,每年药品支出总量增速将保持在3%-6%之间。人口老龄化趋势下,随着60岁以上中老年人口比例持续提升,中国医药行业面临未来二十年的人口结构红利,需求的升级和医药科技的进步将进一步带动产业发展。
2015年以来,我国医药行业进入快速分化、结构升级、淘汰落后产能的阶段。近年来药品审评审批加速以及优先审评政策出台对我国医药产业影响较大,无论进口品种还是国产品种,都呈现出批文数量快速上升的趋势。随着药品审批标准提高,以及仿制药一致性评价持续推进,具有医药自主创新能力以及拥有知识产权保护的企业在未来市场竞争中的优势明显。